内容提要
美国FDA发布关于Abbott-Thoratec公司因在备用控制器更换的过程中存在发生患者损伤或死亡的风险召回HeartMate II左心室辅助(LVAS)囊袋系统控制器的警示信息
美国FDA发布关于Datascope公司CS100、CS100i和CS300主动脉内球囊反搏泵因潜在电气测试故障问题警示信息
美国FDA发布关于Vascular Solutions 公司由于在使用过程中余料可能分裂或分离问题召回Venture导管的警示信息
英国MHRA发布关于Philips Respironics公司 V60呼吸机潜在意外关机故障的警示信息
加拿大Health Canada发布关于Sysmex公司由于系统问题召回CA-620和CA-660血凝分析仪的警示信息
美国FDA发布关于Zimmer Biomet公司因其可能存在对组织和器官引起毒性的潜在有害化学物质召回植入式脊柱融合刺激器
美国FDA发布关于Abbott-Thoratec公司因在备用控制器更换的过程中存在发生患者损伤或死亡的风险召回HeartMate II左心室辅助(LVAS)囊袋系统控制器的警示信息
发布日期:2017年5月23日
召回产品:HeartMate II左心室辅助(LVAS)囊袋系统控制器
型号:105109、106015、106762、107801
制造日期:2012年7月-2016年12月
分销日期:2012年7月-2017年3月
在美国召回的器械数量:共28,882件
器械用途:囊袋系统控制器是通过皮下电极导线(动力传动系统)与植入的HeartMate II LVAS泵连接的电源。该控制器为LVAS系统提供动力,LVAS是在心脏衰弱不能依靠自身泵出足量的血液时使血液循环全身的机械装置。控制器通过电池提供动力或与主电源连接。
HeartMate II LVAS囊袋系统控制器适用于医院内外的使用。为每名患者提供备用系统控制器,以便在器械报警或故障的情况下使用。提供了关于如何从一台系统控制器切换到另外一台的说明和培训。
HeartMate II LVAS囊袋系统控制器的图像

召回原因:在心室辅助治疗的过程中,患者有时可能需要更换为备用的系统控制器。该更换应迅速进行,并在医院内进行,因为这可能对老年患者和/或未接受过培训的患者构成重大挑战。对于这些患者,缓慢或不当的动力传动系统更换会使他们面临严重损伤或死亡的风险。
Abbott-Thoratec已经收到了共计70例事件报告,包括19例损伤和26例死亡。所有的死亡事件都是在患者不在医院时尝试更换控制器时发生的。
为了解决这一问题,Abbott-Thoratec为使用带有囊袋控制器的HeartMate II LVAS的所有用户提供新的升级版软件和硬件,以帮助患者在紧急情况下成功更换其囊袋控制器。
召回措施:Abbott-Thoratec向受到影响的客户发送了“医疗器械紧急纠正”函。该纠正函确定了下列需要采取的措施:
使用新HeartMate II LVAS囊袋系统控制器的患者将收到心室辅助装置(VAD)协调员提供的升级版硬件和软件(包括完全升级的系统控制器,带有新的黄色对位标记和新的电极导线/动力传动系统)。
使用HeartMate II LVAS囊袋系统控制器的现有患者将收到升级版器械软件和警报指南,以供主控和备用控制器使用。如果现有患者需要更换他们的控制器(如损坏或旧型号的控制器),Abbott-Thoratec将免费为其更换,但患者的植入式动力传动系统不会更改为具有匹配黄色标记的系统。
Abbott-Thoratec将联系受到影响的所有医护人员以协调诊室访视,并收到升级版软件和更新的标签。每次诊室访视应包括:在Abbott授权代表的支持下,进行主控和备用系统控制器的软件升级。
l 对患者和看护人员说明最新的软件更新。?警报通知系统已更新,消除了患者系统控制器上的咨询警报。这些是非紧急警报,当患者进入下一次例行预约时,医师将在系统监测器上看到。
l 提示患者在其系统控制器上出现警报的情况下联系VAD协调员,并强调系统控制器更换应由他们的VAD协调员在医院进行。
l 签署并返回附在“医疗器械紧急纠正”函中的确认表。
(美国FDA网站)
美国FDA发布关于Datascope公司CS100、CS100i和CS300主动脉内球囊反搏泵因潜在电气测试故障问题警示信息
发布日期:2017年6月19日
警示产品:主动脉内球囊反搏泵(IABP)
产品型号:CS100、CS100i和CS300
警示原因:因为潜在的电气测试故障代码,Datascope Corp.自愿对其售出的某些主动脉内球囊反搏泵(IABP)进行了一项世界范围的现场纠正。这项现场纠正还适用于转换为CS100i或CS300 IABP的任何98系统或98XT系统 IABP。
Datascope收到了一起器械未能启动治疗而导致患者死亡的相关投诉。本投诉涉及一件CS300 IABP,由于电气测试故障代码58(通电排气测试故障)、维护代码3和自动充气故障导致不能泵送。电气测试故障代码58由电磁阀造成,该电磁阀需要比螺线管驱动板更大的功率才能输送以打开阀门。
接受IABP治疗的患者处于危急状态,治疗的突然中断可能导致危险的血流动力不稳定。
受到影响的IABP装置在美国和全世界(超过100个国家)分销。受到影响的装置是在2003年3月23日到2013年12月11日之间分销的。2013年12月11日之后分销的装置不受现场纠正的影响。
警示措施:Maquet/Getinge指出,当没有替代IABP或替代疗法可用时,医疗团队应为每名患者评估使用受到影响的CA100i、CS100或CS300 IABP的风险受益。在使用受到影响的器械时,请遵照下列说明:
按照用户说明警告,临床医生不得使患者在IABP治疗过程中处于无人照料的状态。
突然关机造成的另外一项危害与球囊在治疗中断过程中的静态状态(不充气或排气)相关。重点注意CS100i、CS100或CS300 IABP操作说明书手册中的下列警告:由于可能形成血栓,患者的球囊不得在患者体内保持不活动状态(即,不充气或排气)超过30分钟。
Datascope建议在插入IAB导管之前给IABP通电,以允许IABP成功完成自检,直至进行维修。该行动将花费不到60秒。在IABP未能成功完成自检并显示电气测试故障代码58的情况下,请停止使用该IABP,并联系您当地的Maquet/Getinge销售与服务办事处。
Datascope的服务代表将更换存在缺陷的螺线管驱动板。Maquet/Getinge服务团队的代表将与持有受到影响的IABP装置的客户联系,并安排现场维修。
关于现场纠正的更多信息,请致电1-888-627-8383并按2与客户服务部联系(周一到周五,8:00 a.m.到6:00 p.m. EDT)。
(美国FDA网站)
美国FDA发布关于Vascular Solutions公司由于在使用过程中余料可能分裂或分离问题召回Venture导管的警示信息
召回日期:2017年6月21日
召回级别:I级。FDA将其确定为I级召回,即最严重的召回类型,使用这些器械可能导致严重伤害或死亡。
召回产品:Venture RX导管(型号5820)、Venture OTW(型号5821)、和Venture CS导管(型号5822)
分销日期:2015年5月7日-2017年4月19日
制造日期:2015年5月7日-2017年3月31日
在美国召回的器械数量:共7054件
器械用途:Venture导管用于引导、操纵、控制和支撑导丝进入手臂、腿、手、足、和心肌的静脉和动脉中。某些型号还可以向血管内给予盐液或药物。
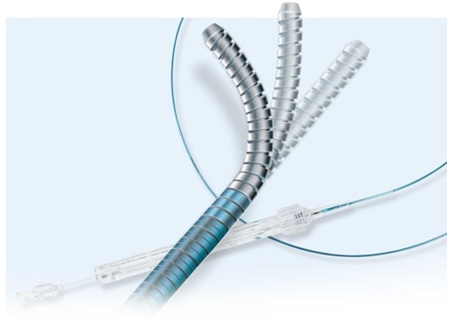
召回原因:Vascular Solutions Inc.正在召回Venture导管,因为使用过程中导管头端存在分裂或分离的风险。导管头端处的余料可能分离,并可进入患者的血流。这会对健康产生严重的不良后果,例如产生血凝块、余料造成生命器官栓塞或死亡。
召回措施:Vascular Solutions Inc.于2017年4月25日向受到影响的所有客户发出了医疗器械紧急召回函。该召回函要求经销商和客户:
• 识别并取出库存中受到影响的任何Venture导管并进行隔离。
• 确保接收了任何受到影响的Venture导管的所有客户均收到了现场安全通告,并填写了客户库存表。
• 受到影响的所有导管均已退回之后,填写Vascular Solutions Inc.经销商库存表,并通过电子邮件返回至regops@vasc.com。
• 收到Vascular Solutions Inc.经销商库存表之后,Vascular Solutions的客户服务部将提供退货授权编号,并安排受到影响的Venture导管的退货。受到影响的器械退回之后,将提供抵账服务。
(美国FDA网站)
英国MHRA发布关于Philips Respironics公司V60呼吸机潜在意外关机故障的警示信息
发布日期:2017年5月17日
警示产品:V60呼吸机
警示原因:由Philips Respironics制造的V60呼吸机软件故障可能造成鼓风电动机停转的误报,导致意外关机。
采取措施:
按照Philips的FSN 86600036A确定软件版本为2.20的所有器械(部分器械可能已被客户在2016年4月17日到2017年1月4日之间升级)。
确保医院的生物医学工程师或者Philips的现场服务工程师安装正确的软件(版本2.10)。
Philips在其FSN中建议不得使用软件版本为2.20的器械,除非可以进行密切的临床观察。
如果无法获取替代器械,对继续使用软件版本2.20的器械进行个体风险评定,直至能够安装版本2.10。
联系Philips Respironics确认收到了FSN。
(英国MHRA网站)
加拿大Health Canada发布关于Sysmex公司由于系统问题召回CA-620和CA-660血凝分析仪的警示信息
发布日期:2017年6月20日
警示产品:A. Sysmex凝血分析仪CA-620 B. Sysmex凝血分析仪CA-660
警示原因:Sysmex Corporation已通知Siemens Healthcare Diagnostics Products Gmbh关于影响CA系列系统的一种现象。在罕见情况下,使用内置条形码扫描仪时,系统可能存在不能提醒操作者关于单个样品ID编号分配给多名患者测量结果的风险。在非常罕见的情况下,由于存在错误匹配患者结果的可能性,可能导致诊断和患者治疗决策不正确。
(加拿大Health Canada网站)
美国FDA发布关于Zimmer Biomet公司因其可能存在对组织和器官引起毒性的潜在有害化学物质召回植入式脊柱融合刺激器
召回日期:2017年5月30日
召回级别:I级。FDA将其确定为I级召回,即最严重的召回类型,使用这些器械可能导致严重伤害或死亡。
召回产品:产品描述:SpF® PLUS-Mini (60μA/W)和SpF® SpF XL IIB型植入式脊柱融合刺激器
序列号:SpF-XL IIB:224595, 224598, 224607, 224608, 224610, 224613, 224615, 224621, 224622, 224623, 224624, 224625, 224626, 224644, 224649, 224651, 224655, 224656, 224658, 224659, 224666, 224667
SpF-PLUS:410093, 410094, 410096, 410103, 410111, 410115, 410119, 410148, 410151, 410158, 410171
分销日期:2017年3月28日-2017年4月6日
制造日期:2016年10月11日-2017年1月18日
在美国召回的器械数量:33
器械用途:Zimmer Biomet SpF PLUS-Mini和SpF XL IIb型植入式脊柱融合刺激器在脊柱融合术中使用,可以增加两个或多个脊椎(脊骨)之间的连接持久性。器械植入于患者背部,并向手术部位提供恒定的电刺激。
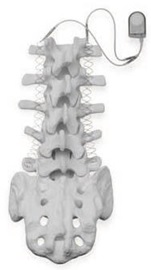
召回原因:Zimmer Biomet正在召回SpF PLUS-Mini和SpF XL IIb型植入式脊柱融合刺激器,因其具有高于所允许水平的潜在有害化学物质(对组织和器官造成毒性(细胞毒性)),这是在公司常规监测程序中发现的。细胞毒性试验是医疗器械生物学评价的一部分,目的是确保器械与人体具有兼容性。阳性细胞毒性试验(失败结果)表明器械包含的潜在有害化学物质的总量或水平可能会对患者健康产生危害。
使用受影响产品可能会导致严重不良健康后果,包括但不限于:慢性感染、由于额外手术治疗而需要长期住院,以及死亡。
采取措施:
2017年4月20日,Zimmer Biomet向所有受影响客户发出医疗器械紧急召回通知,通知中指导客户应:审查通知并将信息分发给所有相关人员;隔离所有受影响产品;Zimmer Biomet销售代表将把受影响产品从机构内取出。如果产品直接从公司购买,请根据Zimmer Biomet提供的确认表上的说明完成退回工作;请将表格发送至corporatequality.postmarket@zimmerbiomet.com或传真至574-372-4265;保留一份有现场行动记录的确认表;告知外科医生,建议对植入受影响器械的患者进行术后3-6个月的常规临床监测。
(美国FDA网站)
扫一扫在手机上查看当前页面

 闽政通APP
闽政通APP
 微信公众号
微信公众号
 闽公网安备:35010202000300号
闽公网安备:35010202000300号